EXPERIMENTO DE LA PILA CASERA
ADRIAN CAMILO GONZALEZ GONZALEZ
Lic. DENNISON ROMERO
INSTITUCION EDUCATIVA ANTONIO NARIÑO
CURSO: 10-2
VILLAVICENCIO
2013
CONTENIDO
- INTRODUCCIÓN
- OBJETIVO GENERAL
- OBJETIVOS ESPECÍFICOS
- MARCO CONCEPTUAL
- MATERIALES
- PROCEDIMIENTO
- RESULTADOS
- OBSERVACIONES
- PREGUNTAS
- RECOMENDACIONES
- CONCLUSIONES
INTRODUCCIÓN
El siguiente trabajo fue realizado con el fin de dar a conocer los diferentes tipos de generadores, pero específicamente la pila. Así profundizaremos el tema indagando en los diferentes medios de comunicación y archivos de los cuales pudiéramos obtener información pertinente para analizar los conceptos básicos en el proceso de elaboración de la misma.
OBJETIVO GENERAL
- Conocer la estructura básica de un generador.
OBJETIVOS ESPECÍFICOS
- Construir una pila con elementos caseros.
- Comprender las reacciones químicas que se generan en una pila.
- Analizar conceptos básicos en la fabricación de una pila.
MARCO CONCEPTUAL
LA PILA
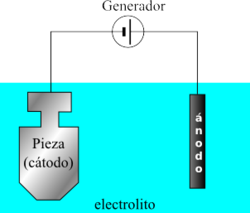
Una pila eléctrica es un dispositivo que convierte energía química en energía eléctrica por un proceso químico transitorio. Se trata de un generador primario. La estructura fundamental de una pila consiste en dos electrodos, metálicos en muchos casos, introducidos en una disolución conductora de electricidad o electrolito.
OXIDACIÓN
Es una reacción química muy poderosa donde un elemento cede electrones, y por lo tanto aumenta su estado de oxidación.
REDUCCIÓN
Es el proceso electro-químico por el cual un átomo o ion gana electrones. Implica la disminución de su estado de oxidación. Es lo contrario a la oxidación.
Es una reacción química muy poderosa donde un elemento cede electrones, y por lo tanto aumenta su estado de oxidación.
REDUCCIÓN
Es el proceso electro-químico por el cual un átomo o ion gana electrones. Implica la disminución de su estado de oxidación. Es lo contrario a la oxidación.
ELECTRODO
Es un conductor eléctrico utilizado para hacer contacto con una parte no metálica de un circuito, por ejemplo un semiconductor, un electrolito, etc.
ElECTROLITO
Es cualquier sustancia que contiene iones libres, que se comportan como un medio conductor eléctrico.
HE AQUÍ UN EJEMPLO
Es un conductor eléctrico utilizado para hacer contacto con una parte no metálica de un circuito, por ejemplo un semiconductor, un electrolito, etc.
ElECTROLITO
Es cualquier sustancia que contiene iones libres, que se comportan como un medio conductor eléctrico.
MATERIALES
- Zumo de limón o en su defecto 8 limones de castilla.
- Tres vasos plásticos. Mínimo de 7 onzas.
- Vinagre.
- Sacapuntas metálico.
- Tubo de cobre.
- Un metro de cable.
- Un led o una tarjeta musical.
PROCEDIMIENTO
- Se toman los 3 vasos de plástico, en uno se añade zumo de limón, en otro vinagre, y en el último la mezcla de los dos.
- Cortar dos pedazos de cable y los pelamos en las puntas.
- Se toma un extremo de cada cable, en uno se amarra el sacapuntas y en el otro el cobre, teniendo en cuenta que el cable rojo este con el cobre y el negro con el sacapuntas.
- Sumergimos los electrodos en el vaso con el zumo de limón y conectamos los cables al multímetro, tomamos nota del resultado en milivoltios y voltios. Hacemos lo mismo en los otros dos vasos.
- Extraemos el mecanismo de la tarjeta musical, le quitamos las pilas y allí conectamos los cables de nuestra pila casera para hacerla funcionar. Si utilizamos el led conectamos los cables con las puntas. En caso dado de que no suene la tarjeta musical o alumbre el led combinamos varias pilas para obtener mas voltaje.
HE AQUÍ UN EJEMPLO
RESULTADOS
Tabla de resultados (3) from CamiloGG
OBSERVACIONES
- Si queremos mas intensidad ya sea en el led o la tarje musical deberemos unir varias pilas.
- El sacapuntas al entrar en contacto con el electrolito cambia de color y se observan algunas burbujas.
PREGUNTAS
- ¿Por qué en algunos casos en el multímetro el resultado sale negativo?
R= Por que estaban invertidos los cables. Había que tener en cuenta que los cables estuvieran conectados al electrodo que les corresponde, el rojo con el cobre y el negro con el sacapuntas.
2. ¿Por qué en algunos casos da mas voltaje con el zumo de limón y no con el vinagre?
R= Porque un electrolito puede ser mejor que otro, esto se debe a que contiene mas iones libres.
3. ¿Por qué es importante que al construir la batería los nodos o electrodos deben de conectarse con la polaridad contraria?
R= Por que de esta manera los electrones fluyen por todo el circuito del polo negativo al polo positivo produciendo la energía.
4. ¿Qué sucede si se deja mucho tiempo los electrodos en el vinagre?
R= Reaccionarían y producirían gas de hidrógeno.
RECOMENDACIONES
- Conectar los electrodos con el cable que les corresponde.
- Estar pendiente de que no se toquen los electrodos dentro del electrolito.
- No dejar mucho tiempo los electrodos en el electrolito por que puede producir gas de hidrógeno.
CONCLUSIONES
- Algunos electrolitos son mejores que otros ya que contienen mas iones libres.
- La pila genera energía química y la transforma a energía eléctrica.
- Si unimos varias pilas obtendremos un mayor voltaje y formaremos una batería.
- Para que se produzca electricidad en la unión de varias pilas los nodos deben conectarse con polaridad contraria para que los electrones vayan del polo negativo al positivo.
CIBERGRAFÍA
- http://es.wikipedia.org/wiki/Pila_el%C3%A9ctrica
- http://es.wikipedia.org/wiki/Reducci%C3%B3n-oxidaci%C3%B3n
- http://es.wikipedia.org/wiki/Electrodo
- http://es.wikipedia.org/wiki/Electrolito














.jpg)
No hay comentarios:
Publicar un comentario